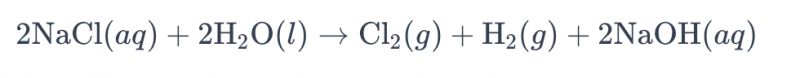Proces elektrolizy roztworu solanki za pomocą elektrod tytanowych w celu wytworzenia chloru jest powszechnie nazywany „elektrolizą solanki”. W tym procesie elektrody tytanowe służą do wspomagania reakcji utleniania jonów chlorkowych w solance, co prowadzi do wytworzenia chloru gazowego. Ogólne równanie reakcji chemicznej przedstawia się następująco:
W tym równaniu jony chlorkowe ulegają utlenianiu na anodzie, co prowadzi do produkcji chloru gazowego, podczas gdy cząsteczki wody ulegają redukcji na katodzie, tworząc wodór. Dodatkowo jony wodorotlenkowe ulegają redukcji na anodzie, tworząc wodór gazowy i wodorotlenek sodu.
Wybór elektrod tytanowych wynika z doskonałej odporności na korozję i przewodności tytanu, co pozwala mu na stabilne zachodzenie reakcji podczas elektrolizy bez korozji. To sprawia, że elektrody tytanowe są idealnym wyborem do elektrolizy solanki.
Elektroliza wody słonej zazwyczaj wymaga zewnętrznego źródła zasilania, które dostarcza energię do reakcji elektrolitycznej. Źródłem tym jest zazwyczaj zasilacz prądu stałego (DC), ponieważ reakcje elektrolityczne wymagają stałego kierunku przepływu prądu, a zasilacz DC może zapewnić stały kierunek przepływu prądu.
W procesie elektrolizy wody zasolonej w celu wytworzenia chloru gazowego powszechnie stosuje się niskonapięciowe źródło zasilania prądem stałym. Napięcie źródła zasilania zależy od konkretnych warunków reakcji i konstrukcji urządzenia, ale zazwyczaj mieści się w zakresie od 2 do 4 woltów. Ponadto, natężenie prądu źródła zasilania jest kluczowym parametrem, który należy określić na podstawie rozmiaru komory reakcyjnej i pożądanej wydajności produkcji.
Podsumowując, wybór źródła zasilania do elektrolizy wody słonej zależy od konkretnych wymagań eksperymentów lub procesów przemysłowych, aby zagwarantować skuteczną reakcję i uzyskanie pożądanych produktów.
Czas publikacji: 16-01-2024